Méthane
Le méthane est un hydrocarbure de la famille des alcanes.
Définitions :
- Gaz inodore, incolore et combustible qui est plus léger que l'air et qui est le principal composant des gaz d'enfouissement (source : tpsgc-pwgsc.gc)
- Gaz à effet de serre émis dans l'atmosphère par des sources naturelles comme les milieux humides, mais provenant aussi d'un certain nombre de sources anthropiques, surtout le fumier, les rizières, les décharges municipales, les mines de charbon et les fuites de puits de forage et d... (source : ec.gc)
- Gaz incolore et inflammable, le méthane se dégage des végétaux en décomposition ou de la part fermentescible des ordures ménagères. (source : csdu-lapouyade)
| Méthane | ||
|---|---|---|
  |
||
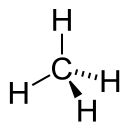
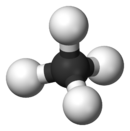
| Représentation de Cram et vue 3D | ||
| Général | ||
| Nom IUPAC | Méthane | |
| N° CAS | 74-82-8 | |
| N° EINECS | ||
| PubChem | ||
| SMILES |
|
|
| InChI |
|
|
| Apparence | gaz | |
| Propriétés chimiques | ||
| Formule brute | CH4 [Isomères] | |
| Masse molaire | 16,0425 g∙mol-1 | |
| Propriétés physiques | ||
| T° fusion | 90,55 K (-182,6 °C) | |
| T° vaporisation | 111,75 K (-161,4 °C) | |
| Densité | 415 kg/m³ (à -164 °C), sous forme gazeuse 0.717 kg/m³ |
|
| T° d'auto-inflammation | 540 °C | |
| Précautions | ||
|
|
||
|
||
| Phrases R | 12
|
|
| Phrases S | 9 - 16 - 33 | |
|
|
||
Le méthane est un hydrocarbure de la famille des alcanes.
De formule brute CH4, la molécule de méthane est formée d'un atome de carbone (C) et quatre atomes d'hydrogène (H).
Elle est désignée par le code R50 dans la liste des gaz fluorés et frigorigènes.
C'est un des principaux gaz à effet de serre.
Science
Le méthane est le composant principal du gaz naturel.
Formation
C'est le principal constituant du biogaz issu de la fermentation de matières organiques animales ou végétales en l'absence d'oxygène. Il est fabriqué par des bactéries méthanogènes qui vivent dans des milieux anaérobiques c'est-à-dire sans oxygène.
Le méthane est ainsi l'unique hydrocarbure classique qui peut être obtenu rapidement et aisément grâce à un processus biologique naturel. Nous utilisons essentiellement du gaz naturel et par conséquent du méthane fossile, mais l'utilisation du méthane renouvelable, aussi appelé biogaz, est en développement : Suède, Allemagne, Danemark, Viet-Nam, Cambodge, Chine, Inde...
Le méthane se dégage naturellement des zones humides peu oxygénées comme les marais et les terres inondées. Il se forme aussi dans l'estomac des mammifères. Ce gaz est d'ailleurs présent en faible quantité dans les flatulences humaines [1].
Des quantités importantes de méthane sont piégées sous forme d'hydrates de méthane (clathrates) au fond des océans ; leur exploitation est envisagée (2007).
Propriétés
| Point triple | 90,68 K (-182,47 °C) |
| 11,7 kPa | |
| Point critique | 190,45 K (-82,7 °C) |
| 4,596 MPa |
- Aux conditions normales de température et de pression, c'est un gaz plus léger que l'air, incolore et inodore. Il se liquéfie à -161,4 °C et se solidifie à -182,6 °C.
- La densité du méthane liquide est de 0,415 à -164 °C.
- Sa solubilité dans l'eau est de 0,4 ml pour 100 ml d'eau à la température de 20 °C, cette solubilité dans l'alcool est de 47 ml à la même température et de 104 ml à 10 °C dans l'éther, systématiquement pour le même volume de 100 ml.
- Le méthane est un combustible. Sa température d'auto-inflammation dans l'air est de 540 °C [2]. La réaction de combustion du méthane s'écrit :
- 1 m³ de méthane à 15 °C (gaz naturel) libère une énergie de 9,89 kWh (35,6 MJ)
- Le gaz naturel, (constitué à plus de 90% de méthane) est transporté par navires (méthaniers) à une température de -162 °C ainsi qu'à une pression voisine de la pression atmosphérique. Les réservoirs sont construits sur le principe de la «bouteille thermos» et leur capacité peut aller jusqu'à 40 ou 50 000 m³ de gaz liquide par réservoir. Un méthanier comportant plusieurs réservoirs, sa cargaison peut aujourd'hui atteindre 154 000 m³ de GNL, Gaz Naturel Liquéfié. Les futurs méthaniers pourront transporter jusqu'à 260 000 m³ de GNL. Le volume du méthane à l'état gazeux est égal à 600 fois son volume à l'état liquide, à pression atmosphérique.
- Très inflammable, mais plus léger que l'air, le méthane en milieu non confiné s'échappe vers la haute atmosphère ; il a par conséquent moins tendance que les gaz plus lourds que l'air (propane, butane) à former des nuages explosifs.
- Présent à tous les stades de l'industrie pétrolière, mais mal valorisé, il est souvent brûlé dans une torchère ; ce comportement contribuant à l'effet de serre, les pétroliers tentent de façon croissante de restreindre ce procédé.
Le méthane dans l'Univers (source ESA)
- Le méthane a été retrouvé à l'état de traces dans plusieurs nuages interstellaires.
- Le méthane se trouve partout sur Titan, et même sous forme de lacs, de rivières, et de mers. Sa présence en a été établie dès 1944. Au point que la chaleur dégagée par la sonde Huygens, lors de l'impact du 14 janvier 2005 a provoqué un notable dégagement de méthane gazeux.
- Titan présente une atmosphère uniforme d'azote-méthane. Il ne pleuvait pas quand la sonde Huygens s'est posée sur Titan, mais l'ESA n'exclut pas que des averses de méthane y soient fréquentes. Simplement, l'aridité du sol absorberait rapidement ces précipitations, à la manière des déserts terrestres.
- Des traces de méthane ont aussi été découvertes dans l'atmosphère de Mars. [3]
- Quelque part, dans l'Univers, une vie à base de méthane et non plus d'eau est-elle concevable sinon possible ? C'est l'une des grandes questions posées par cette mission. Avec Cassini c'est par conséquent toute notre conception des exoplanètes (et par conséquent du monde) qui est à revoir.
- L'atmosphère de méthane y permettrait le vol de «moins lourds que l'air» au point que les planétologues de l'ESA, rêvent d'y envoyer des ballons, des montgolfières, des robots mobiles… afin de comprendre ce monde extraterrestre dont on ne vient d'explorer qu'une infime partie.
- Dans quatre milliards d'années, quand le soleil enflera exorbitantment avant d'exploser et d'engloutir la Terre, les planétologues s'amusant à imaginer le temps qu'il ferait sur Titan, pensent qu'il devrait faire bon y vivre dans son atmosphère de méthane (pendant un bref moment seulement).
Histoire
Alessandro Volta découvre le méthane en 1776 en s'intéressant au «gaz des marais» (l'ancien nom du méthane).
C'est à cause du grisou, responsable (encore aujourd'hui) de trop nombreuses catastrophes minières que furent mises au point, les lampes de sûreté dans les mines de charbon, et surtout la lampe de Davy.
Jusqu'aux années 1970, l'impact du méthane sur le climat était inconnu. En 1976, il a été démontré que le méthane était un gaz à effet de serre.
Ce n'est qu'avec la conquête spatiale qu'on a découvert l'omniprésence de ce corps dans l'Univers.
Utilisation
Les gisements fossiles de gaz naturel comportent entre 50 et 60 % de méthane, le gaz naturel brut est épuré avant d'être injecté sur le réseau de distribution. La proportion de méthane présent dans le gaz naturel que nous utilisons est supérieure à 90% dans la majorité des gaz.
Le méthane biologique, ou biogaz, qui est produit par la fermentation anaérobie de matière organique comporte 50 à 80 % de méthane, (60-65% le plus souvent)
Le biogaz produit dans les décharges pourrait être (bien davantage) récupéré et valorisé sous forme d'électricité, de chaleur ou comme carburant automobile. Pour l'instant, seules quelques expériences isolées (dans des fermes, des déchèteries... ) ont vu le jour, spécialement dans les régions les plus froides (nord de l'Allemagne, de la France, Scandinavie... ), mais la rentabilité économique de ces installations est loin d'être acquise. [réf. nécessaire] (voir l'expérience en prison rwandaise)
Environnement : contribution à l'effet de serre
Le méthane, gaz à effet de serre
Le méthane est un gaz à effet de serre qui influe sur le climat. Il absorbe une partie du rayonnement infrarouge émis par la Terre, et l'empêche ainsi de s'échapper vers l'espace. Ce phénomène contribue au réchauffement de la Terre.
De plus il contribue aussi indirectement à l'effet de serre en diminuant la capacité de l'atmosphère à oxyder d'autres gaz à effet de serre (comme les fréons). Son utilisation comme combustible émet du CO2 à hauteur de 380 Mt/an (les émissions industrielles avoisinent 6000 Mt/an) et de la vapeur d'eau, autre gaz à effet de serre important.
L'influence du méthane sur le climat est moins importante que celle du dioxyde de carbone mais elle est lorsque même préoccupante. Une molécule de méthane absorbe en moyenne 25 fois plus de rayonnement qu'une molécule de dioxyde de carbone sur une période de 100 ans, son potentiel de réchauffement global (PRG) est par conséquent de 25 ; à échéance 20 ans, son PRG est même de 62. Le méthane est reconnu comme le 3e gaz responsable du dérèglement climatique, après le CO2 et les fréons) [4].
Dans le passé, le taux de méthane dans l'atmosphère a varié comme la température. La concentration de méthane a augmenté d'environ 150 % depuis 1750 et atteint actuellement un taux inégalé dans l'histoire. Cette augmentation est essentiellement due aux activités humaines.
On estime que sans sa présence, la température moyenne de surface de la Terre serait plus basse de 1,3 °C.
Sources de méthane
Globalement, on estime les émissions de CH4 vers l'atmosphère à 500 Mt/an, dont les trois quarts proviennent de sources d'origine anthropique.
Les principales sources (par ordre d'importance quantitative estimée) sont[réf. nécessaire] :
- La fermentation anaérobie sous l'eau : 32% des émissions.
Elles ont en particulier lieu dans les zones humides (naturelles ou artificielles avec surtout les rizières et barrages hydroélectriques qui ont inondé des forêts ou accumulé une importante charge organique. Il peut aussi s'agir d'estuaires devenus dystrophes ou de n'importe quelle zone d'accumulation de pollution organique, décharge par exemple).
Les marais, les mangroves tropicales et les rizières sont sujets à l'action de bactéries méthanogènes en milieu anaérobie.
La température agit sur les émissions, qui atteignent leur valeur maximale entre 37 °C et 48 °C, d'où une augmentcation des émissions en cas de réchauffement.. En présence d'une quantité suffisante d'oxygène, l'activité bactérienne elle-même contribue à échauffer le matériau, mais avec émission de CO2.
L'analyse des gaz piégés il y a 10 000 ans dans les glaces polaires et l'étude du rapport isotopique carbone 13/carbone 12 du carbone de ces molécules de méthane (δ13CH4) ont montré un doublement des taux de CH4 lors de la dernière transition glaciaire-interglaciaire. Ce doublement est dû, à près de 50 %, aux régions marécageuses tropicales, renforcées par les émissions des tourbières boréales favorisées par la transition climatique[5]
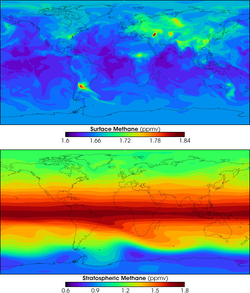
- Les énergies fossiles : 21% des émissions.
Le gaz naturel est composé à 90% de méthane. Les fuites dans l'atmosphère lors de son extraction, de son transport, de son traitement et de sa distribution pourraient représenter jusqu'à 2% de la production de gaz naturel, les trois-quarts de ces fuites ayant lieu chez le client, après le compteur. Le graphe ci-contre montre aussi l'importance des pertes lors de la production : on distingue clairement certains champs gaziers de grande taille, entre autres la mer Caspienne et la Sibérie.
De même, le gaz piégé dans les filons de charbon lors de sa formation (le grisou) est relâché lors de l'extraction du minerai. Si on ne veut pas diminuer l'utilisation de ces énergies fossiles et sans un investissement massif dans les énergies alternatives, il faut par conséquent rechercher des solutions pour limiter les fuites.
- Les ruminants : 16% des émissions.
Le méthane est un produit de la digestion incomplète lors de la fermentation gastro-entérique des ruminants, en particulier lorsque les animaux sont nourris avec des protéagineux (soja surtout). Une seule vache peut émettre 100 à 500 litres de méthane par jour. À cela s'ajoutent les émissions liées aux déchets (excréments, fumier d'étable) qui continuent leur décomposition avec une méthanisation plus ou moins marquée selon le contexte. Parmi les solutions étudiées : perfectionner l'alimentation animale, éviter le stockage des déchets qui ne produisent du méthane qu'à l'abri de l'air, ou au contraire récupérer ce méthane et le valoriser énergétiquement. L'apport de lipides alimentaires riches en acides gras polyinsaturés dans la ration des ruminants est une piste prometteuse. Des essais menés sur vaches laitières au centre INRA de Clermont ont montré qu'un apport de 6% de lipides issus de la graine de lin a diminué la production de méthane des animaux de 27 à 37%. [6]
- Les déchets humains : 12% des émissions.
Les décharges fermentent et émettent de grandes quantité de méthane ; ce gaz pourrait être réutilisé comme source d'énergie.
- La biomasse : 10% des émissions.
Le méthane émis provient en particulier de l'oxydation incomplète des végétaux, lors de certains processus de décomposition organique naturelle (comme les feuilles mortes des sous-bois accumulées sous l'eau, fermentation de vases riches en matière organique). Certaines espèces (Termites peuvent produire des quantités significatives de méthane)
- Les sédiments et océans : 4% des émissions, mais qui pourrait fortement augmenter.
Les hydrates contenant du méthane (clathrates) pourraient émettre du gaz en cas de perturbation de la température océanique et/ou du dégel de certains sols riches de la toundra sibérienne et canadienne, mais ces émissions sont limitées aujourd'hui.
Toutefois, une augmentation de température entraîne une augmentation de l'émission de CH4 par les clathrates. Cette source pourrait par conséquent former une véritable bombe à retardement climatique en cas de réchauffement des fonds océaniques.
Prospective : Les variations futures de ces émissions sont incertaines, mais on prévoit une augmentation des apports de l'énergie fossile, des déchets, des sources agricoles et marines du fait du développement de la population mondiale, de l'industrialisation de certains pays et de la demande croissante en énergie, mais aussi du réchauffement climatique.
Les puits de méthane
Les différents mécanismes d'élimination du méthane atmosphérique retirent environ 515 Mt/an. Le principal puits à CH4 est le radical hydroxyle OH. contenu dans l'atmosphère, qui contribue à 90% de la disparition de CH4. Le radical OH•, agent oxydant des principaux polluants de l'atmosphère (CH4, CO, NOx, composés organiques), provient de la dissociation photochimique de O₃ et de H2O. La teneur en radical hydroxyle est par conséquent influencée par la concentration atmosphérique en CH4 mais également par celle de ses produits, dont CO. De même, divers mécanismes affectent la teneur en OH. :
- l'augmentation de concentration urbaine en NOx engendre plus de formation d'O3 et par conséquent plus de dissociation en OH. ;
- la chute de la concentration d'O3 stratosphérique induit plus de rayonnement UV atteignant la troposphère et par conséquent plus de dissociation d'O3 troposphérique ;
- l'augmentation de la vapeur d'eau résultant de l'augmentation de la température moyenne produit plus de nuages bloquant les flux de protons, effet réduisant la formation d'OH•, et plus de vapeur d'eau, réactif de formation d'OH•.
On a constaté que depuis 1750, le niveau d'OH• a diminué d'environ 20% du fait de l'augmentation en CO et CH4, et est actuellement stable. D'ici 2050, ce niveau devrait encore diminuer de 25%, ce qui aura un impact important sur les teneurs en éléments traces gazeux. Les 10% restants sont dus à l'oxydation du méthane en terrain sec par des bactéries méthanotrophes qui l'utilisent comme source de carbone, mais aussi par son transfert vers la stratosphère.
L'évolution de la concentration en méthane semble marquer le pas[7] (2007) ; cela pourrait s'expliquer par une destruction accélérée de molécules d'ozone O₃, catalysée par des radicaux NO. en plus grande quantité[8], . [9]
Réduire les émissions de méthane
Il existe des moyens de diminuer les émissions de méthane pour diminuer son action sur l'effet de serre :
- capter le méthane, ou biogaz, émis au niveau des décharges d'ordures ou stations d'épuration et le brûler (la combustion forme du CO2 qui a un effet de serre moins important). Cela permettrait de remplacer en partie d'autres énergies fossiles au lieu de le brûler en torchère comme c'est fréquemment le cas aujourd'hui ;
- capter et utiliser le méthane, ou biogaz, produit au niveau des systèmes de stockage des effluents d'élevages ; récupérer le méthane émis lors de l'exploitation minière et après celle-ci ;.
- Développer une riziculture moins productrices de méthane, diminuer les taux de fertilisants, lutter contre la turbidité des eaux et la production de sédiments méthanogènes, et par conséquent en amont contre l'érosion, la régression et dégradation des sols.
- au niveau personnel :
- diminuer sa consommation de viande (en particulier bovine) ;
- diminuer sa consommation de riz (voir le lien entre riziculture et l'effet de serre) ;
- composter ses déchets en veillant à ce que le compost soit suffisamment aéré et drainé.
Notes et références
- ↑ Suarez F., Furne J, Springfield J, Levitt M, «Insights into human colonic physiology obtained from the study of flatus composition», dans Am J Physiol, vol. 272 (5 Pt 1), 1997, p. G1028–33.
- ↑ Température d'auto-inflammation du méthane dans l'air
- ↑ Atreya S, Le méthane, signe de vie sur Mars et Titan ?, Pour la Science, 2007, juin 2007, p38-45
- ↑ Benjamin Dessus, Hervé Le Treut et Bernard Laponche, «Effet de serre, n'oublions pas le méthane» dans La Recherche (ISSN 0029-5671) n°417 (mars 2008) [lire en ligne (page consultée le 25 juillet 2008) ]
- ↑ Nature, Avril 2008
- ↑ Journal of Animal Science, 2007
- ↑ Evolution de la concentration de méthane dans l'atmosphère
- ↑ Réactivité du méthane et de l'ozone en haute atmosphère
- ↑ Inversion des sources et puits de gaz dans l'atmospgère
Les premiers alcanes : méthane, éthane, propane, butane, pentane, hexane, heptane, octane, nonane, décane
Voir aussi
- Gaz à effet de serre
- Environnement
- Hydrate de méthane
- Méthanogène (espèce produisant du méthane) ;
- Méthanotrophes (espèces consommant du méthane pour s'en nourrir)
Recherche sur Google Images : |
|
"Le méthane (CH4) et le protoxyde ..." L'image ci-contre est extraite du site www.manicore.com Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (394 x 309 - 14 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : Refaire la recherche Refaire la recherche |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/11/2008.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.



 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité