Acétate de cuivre
L'Acétate de cuivre (II), est un composé chimique avec la formule brute : Cu 2 (OAc) 4 ou (AcO -) est l'acétate (CH 3 CO 2 -).
| |||||
|---|---|---|---|---|---|
|
| |||||
| Général | |||||
| Formule brute | Cu2 (OAc) 4 C4H6CuO4 Cu (CH3COO) 2 | ||||
| DCI | {{{DCI}}} | ||||
| Nom IUPAC | |||||
| Numéro CAS | anhydre 142-71-2 monohydrate 6046-93-1 | ||||
| Numéro EINECS | {{{EINECS}}} | ||||
| Code ATC | |||||
| PubChem | |||||
| DrugBank | |||||
| Apparence | anhydre : vert à bleu-vert, monohydrate : cristaux inodores | ||||
| Autres noms | {{{Autres noms}}} | ||||
| SMILES | |||||
| InChI | |||||
| Propriétés physiques | |||||
| Masse moléculaire | 181,64 g/mol | ||||
| Température de fusion |
monohydrate 115 °C | ||||
| Température de vaporisation |
décomposition | ||||
| Solubilité | monohydrate 72 g/l eau à 20 °C peu soluble dans l'alcool | ||||
| Densité | monohydrate 1,88 g/cm³ | ||||
| Thermochimie | |||||
| S0gaz, 1 bar | |||||
| S0liquide, 1 bar | |||||
| S0solid | |||||
| ΔfH0gaz | |||||
| ΔfH0liquide | |||||
| ΔfH0solide | |||||
| Cp | |||||
| Chaleur latente de fusion |
N/A | ||||
| Chaleur latente de vaporisation |
N/A | ||||
| Point critique | |||||
| Point triple | |||||
| Toxicologie | |||||
| Classification UE |
 | ||||
| Phrases R | 22 | ||||
| Phrases S | 36 | ||||
| Inhalation | |||||
| Peau | |||||
| Yeux | |||||
| Ingestion | |||||
| Autres infos | |||||
| Symbole | [[Image :hazard_{{{image1}}}. svg|50px]] | ||||
| Symbole | [[Image :hazard_{{{image2}}}. svg|50px]] | ||||
| Symbole | [[Image :hazard_{{{image3}}}. svg|50px]] | ||||
| Unités du SI & CNTP, sauf indication contraire. | |||||
L'Acétate de cuivre (II) , est un composé chimique avec la formule brute : Cu2 (OAc) 4 ou (AcO-) est l'acétate (CH3CO2-).
Autres noms de l'Acétate de cuivre ou Acétate de cuivre (II) :
- Acétate cuivrique
- Acétate cuivrique anhydre
- Diacétate de cuivre
- Acétate cuprique
- Acétate de cuivre (II) anhydre
Le Cu2 (OAc) 4 est un vert foncé solide cristallin, alors que le Cu2 (OAc) 4 (H2O) 2 est plus bleu-vert.
Depuis l'Antiquité, l'acétate de cuivre fut utilisé comme fongicide et colorant (pigments vert).
On a bien entendu reproduit ce processus naturel à l'aide, d'un élément acide le marc de raisin, (processus de fermentation à l'air) ce qui explique que la production d'acétate de cuivre fut concentrée dans certaines zones viticoles.
Aujourd'hui, le Cu2 (OAc) 4 est utilisé comme une source de cuivre en synthèse inorganique et comme un catalyseur ou un agent oxydant en synthèse organique. L'acétate de cuivre, comme tous les composés de cuivre, émet un bleu-vert brillant dans une flamme.
L'acétate de Cuivre (II) est le principal composant du vert-de-gris, une substance bleue-verte qui se forme sur le cuivre après de longues expositions à l'atmosphère. Il fut historiquement constaté dans les vignobles, étant donné que l'acide acétique est un sous-produit de la fermentation. Cette fermentation à l'air laisse apparaître un fond bleu à l'extérieur de la feuille. Il suffit dans ce cas de gratter et de le dissoudre dans l'eau.
Ce composé chimique a été utilisé comme pigment ou fut mélangé avec de l'anhydride arsénieux ou trioxyde d'arsenic, ou encore oxyde arsénieux appelé autrefois «arsenic blanc» sous forme de vert de Paris, ou acéto-arsénite de cuivre un puissant insecticide et fongicide.
Liens externes
Recherche sur Google Images : |
|
"Comment fabriquer le vert de gris ?" L'image ci-contre est extraite du site www.cyberfanny.com Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (460 x 295 - 29 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) :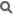 Refaire la recherche Refaire la recherche |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 12/11/2008.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.



 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité