Isotope
En physique nucléaire et en chimie, deux atomes sont dits isotopes s'ils ont le même nombre de protons mais un nombre de neutrons différent.
Définitions :
- atome ayant le même nombre de proton et un nombre différent de neutron. Ils appartiennent au même élément chimique.... (source : tpesteradioactivite.ifrance)
- atome qui change d'un autre seulement par le nombre de neutrons contenus dans son noyau. (source : edf)
- Éléments chimique de même numéro atomique, mais qui changent par leur masse atomique. (source : cours.kestudy)
En physique nucléaire et en chimie, deux atomes sont dits isotopes s'ils ont le même nombre de protons mais un nombre de neutrons différent. Le nombre de protons dans le noyau d'un atome est désigné par le numéro atomique Z. Deux isotopes ont le même Z. Ce qui distingue deux isotopes est qu'ils ont une masse atomique A différente. La masse atomique d'un atome est le nombre de nucléons que contient le noyau de cet atome. La différence de masse atomique est par conséquent due à une différence dans le nombre de neutrons N.
En mots plus simple, ce sont des atomes qui se différencient seulement par leur nombre de neutrons, exception faite des cas d'ionisation (où on a aussi des nombres d'électrons différents).
Notation
Un isotope est couramment désigné par son symbole chimique, complété :
- par son nombre de masse A (égal au nombre de nucléons de l'atome) positionné en haut ainsi qu'à gauche du symbole et
- par le numéro atomique Z, positionné en bas ainsi qu'à gauche du symbole.
Le carbone 14, 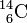 et le carbone 12
et le carbone 12 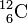 sont des isotopes.
sont des isotopes.
Propriétés des isotopes
Les propriétés chimiques des isotopes d'un même élément sont identiques car ces isotopes ont le même nombre d'électrons (et de protons).
En revanche, comme le noyau ne comporte pas le même nombre de neutrons, la masse des atomes varie. Cette différence de masse atomique permet de séparer les isotopes d'un même élément par spectrométrie de masse ou par centrifugation et ainsi de les distinguer. De plus, la proportion de neutrons dans le noyau peut rendre l'atome instable : c'est pourquoi ils peuvent être radioactifs.
Stabilité des isotopes
Il existe quatre-vingt douze éléments chimiques différents dans la nature, de l'hydrogène 1H au plutonium 94Pu ; le technétium 43Tc et le prométhium 61Pm n'ayant ni isotope stable, ni isotope radioactif de période suffisamment longue.
Le noyau d'un atome est formé de protons qui se repoussent sous l'effet de l'interaction électromagnétique (les charges électriques de même nature se repoussent) mais qui s'attirent sous l'effet de l'interaction forte; il contient aussi des neutrons qui s'attirent sous l'effet de l'interaction forte mais ne sont pas (très très peu) concernés pas l'interaction électromagnétique. Dans un noyau, la stabilité est par conséquent assurée par l'interaction forte, et par les neutrons qui, éloignant les protons les uns des autres par leur seule présence, diminuent l'interaction électromagnétique, d'où les propriétés suivantes :
Pour ces centaines d'isotopes naturels, les nombres respectifs de protons et de neutrons semblent respecter certaines règles :
- le nombre de neutrons est à peu près égal à celui des protons pour les éléments légers ; à partir du 24Cr, le nombre de neutrons devient supérieur au nombre de protons, l'excédent dépassant 50% pour les éléments les plus lourds ;
- certains noyaux particulièrement stables contiennent des protons ou des neutrons (ou les deux) égal à un des nombres (dit magiques) de la série :
- 2,8,20,50,82,126 ;
Pourquoi ces valeurs : Elles correspondent à des noyaux possédant des couches complètes de neutrons ou de protons. Les règles de couches pleines sont assez simples et assez semblables à celles des couches d'électrons Pour retrouver ces valeurs on considère les couches successives du centre vers la périphérie du noyau : s1/2 p3/2 1/2 d5/2 3/2 f7/2 5/2 g9/2 7/2 h11/ 9/2.
Les règles :
Le niveau s contient 1+ 1/2.2 protons et ou neutrons soit 2 et forme la première couche.
Le niveau p en contient 1+ 3/2.2+1+1/2.2 soit 6 à ajouter à la couche s soit 6+2= 8.
La troisième couche contient les niveaux s et d on trouve aisément 10 à ajouter à 8 soit 20.
La quatrième couche contient les niveaux p et f soit 20 ce qui devrait faire 20+20= 40 mais le potentiel crée par le centre du noyau fait que le premier élément du niveau g est proche de la 4e couche et il faut ajouter à cette couche g9/2 soit 10 nucléons ainsi la 4e couche se trouve pour 50 nucléons.
La cinquième couche comporte les niveaux s d g (amputé du g 9/2) et ajouté du h11/2 soit 76 ajouté au 50 précédent fait un total de 126. On y trouve surtout le plomb dont l'isotope le plus stable contient 82 protons et 126 neutons. Il est doublement magique. la valeur suivante est 184.
Ce sont des noyaux sphériques. Entre ces valeurs se trouvent des noyaux déformés en cigare ou en soucoupe, moins stables. Le noyau à 126 protons n'a pas pu être créé encore ; il sera instable probablement mais on approche de cette valeur en combinant 2 atomes.
- les éléments de nombre Z impair possèdent moins d'isotopes stables que les éléments de nombre Z pair.
Utilisation des isotopes
Un exemple très connu de couple d'isotopes est formé par le carbone : le carbone est présent en grande majorité sous son isotope de poids atomique 12 (le «carbone 12») ; d'autre part, on peut trouver en faible quantité l'isotope de poids atomique 14 (le carbone 14), qui est chimiquement strictement équivalent au carbone 12, mais qui est radioactif. En effet, les neutrons supplémentaires du noyau rendent l'atome instable. Il se désintègre en donnant de l'azote et en émettant un rayonnement bêta.
La proportion de l'isotope stable comparé à l'isotope instable est la même dans l'atmosphère et dans les tissus des êtres vivants mais elle varie régulièrement au cours du temps à la mort de l'individu puisque les échanges sont stoppés. C'est sur cette variation que se base la plus connue des méthodes de datation radioactive par couple d'isotopes, qui est la méthode de datation par le carbone 14. C'est sans doute l'application principale du concept d'isotope. Les traceurs isotopiques sont une autre application de ce concept.
Une application majeure est la séparation des isotopes 235 et 238 de l'uranium ; cette séparation est obtenue par diffusion gazeuse ou centrifugation de UF6. Le mode par centrifugation est aux mains de quelques industriels canadiens, russes, européens… La centrifugation est obtenue par une cascade de centrifugeuses qui élèvent petit à petit le taux de U 235 dans le mélange U 235-U 238 qui peut servir pour un enrichissement de 5 % à des applications civile de fission ou à 90 % pour des applications militaires. Les centrifugeuses sont des cylindres étroits tournant à vitesse élevée.
On sait que la force centrifuge est égale à M. w². r où M est la masse unitaire, w la vitesse angulaire de rotation, r le rayon du cylindre. Pour éviter une rupture mécanique on choisit r petit et afin d'avoir une force appréciable on choisit w très élevée (la force est proportionnelle au carré de la rotation). Avec quelques milliers de centrifugeuses, on obtient le résultat recherché.
Anecdotes
Dans la série animée les Simpson, l'équipe de baseball de Springfield se nomme Les Isotopes dont le sponsor n'est autre que la centrale nucléaire de Springfield et la bière Duff.
Voir aussi
Liens externe
- (en) The Isotopes Project Home Page (Compilation et diffusion de données sur les isotopes)
Recherche sur Google Images : |
|
"neutron(s). 3H (isotope 3 de ..." L'image ci-contre est extraite du site chimie.net.free.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (332 x 353 - 36 ko - gif)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : Refaire la recherche Refaire la recherche |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/11/2008.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité