Uranium
L'uranium est un élément chimique de symbole U et de numéro atomique 92. C'est un élément naturel assez fréquent : plus abondant que l'argent, tout autant que le molybdène ou l'arsenic, quatre fois moins abondant que le thorium.
Définitions :
- Métal gris, dur et radioactif. (source : mcq)
- élément de numéro atomique 92, qui se présente à l'état naturel sous la forme d'un mélange comportant trois principaux isotopes... (source : industrie.gouv)
L'uranium est un élément chimique de symbole U et de numéro atomique 92. C'est un élément naturel assez fréquent : plus abondant que l'argent, tout autant que le molybdène ou l'arsenic, quatre fois moins abondant que le thorium. On le trouve partout à l'état de traces, y compris dans l'eau de mer.
C'est un métal lourd radioactif (émetteur alpha) de période très longue (4,5 milliards d'années pour l'uranium 238 et 700 millions pour l'uranium 235). L'isotope U-235 est l'unique élément fissible naturel. Sa fission libère une énergie voisine de 200 MeV par atome fissionné. Cette énergie est environ un million de fois supérieure à celle des combustibles fossiles pour une même masse de combustible mise en jeu. De ce fait, c'est actuellement la matière première initiale pour toute l'industrie nucléaire; cependant le thorium représente aussi un combustible potentiel pour l'énergie nucléaire de fission.
L'uranium naturel
Abondance
L'uranium naturel est présent dans quasiment tous les milieux naturels : roches et eau. Il y a en effet 3 mg d'uranium par mètre cube d'eau de mer[1], ce qui représente 45 milliards de tonnes d'uranium dans les océans.
L'uranium est présent dans tous les types d'eau : le Rhône en charrie en effet près de 29 tonnes environ annuellement. Cet uranium provient du ruissellement des pluies sur les Alpes. L'extraction de l'uranium de l'eau n'aurait cependant aucune rentabilité énergétique. [2]
L'uranium est répandu dans toute l'écorce terrestre, surtout dans les terrains granitiques et sédimentaires. La concentration d'uranium dans ces roches est de l'ordre de 3 g/tonne[3]. À titre d'exemple, un jardin carré de 20 m de côté contient, pour une profondeur de 10 m, environ 24 kg d'uranium.
À l'époque géologique actuelle, la chaleur interne de la Terre provient essentiellement de la désintégration de corps radioactifs, surtout l'uranium 238 et 235 (et quelques autres). [4]
Découverte de l'uranium
L'uranium est mis en évidence en 1789 par le chimiste prussien Martin Heinrich Klaproth qui examine un morceau de roche qu'on lui a apporté de Saint Joachchimsthal[5]. Cette roche est de la pechblende (UO2), un minerai d'uranium. Klaproth donna le nom d'«urane» ou «uranite» au composé qu'il venait d'identifier, en référence à la découverte de la planète Uranus faite par William Herschel 8 ans plus tôt (1781).
Ce n'est qu'en 1841 que le chimiste français Eugène-Melchior Péligot établit que l'urane était composé de deux atomes d'oxygène et d'un de métal qu'il isola et appela uranium. Il estima alors[6] la masse volumique de l'uranium à 19 g/cm3.
Henri Becquerel ne découvrit la propriété radioactive de l'uranium que bien plus tard, en 1896, lorsqu'il constata que des plaques photographiques positionnées à côté de sels d'uranium avait été impressionnées sans avoir été exposées à la lumière. Les plaques avaient été noircies par les rayonnements émis par les sels : le Français Henri Becquerel avait découvert le phénomène de la radioactivité naturelle.
Gisements et exploitation
L'uranium dans la mer et les eaux naturelles
Les concentrations en uranium (l'élément chimique uranium) dans les eaux «naturelles» sont les suivants :
- La mer : 3,3 micro g/l = 0,0033 g/l = 3,3 µg/l
- Le Rhône : 0,56 micro µg/l (débit annuel d'uranium = 29 tonnes)
- L'Indus 4,94 µg/l
- Le Gange 7 µg/l
- Le Huang Ho 7,5 µg/l
Dans les eaux de boisson
- Eau de Badoit : 58µg/l à la source, 5,45µg/l après traitement [7]
- Eau de Vichy : 20µg/l
- Le seuil OMS pour les eaux de boisson est fixé à 15 µg/l
Propriétés chimiques
De symbole U, l'uranium est le dernier élément naturel du tableau périodique de Mendeleïev. Chaque atome d'uranium possède 92 protons et entre 126 et 150 neutrons.
A l'état pur, l'uranium solide est un métal radioactif gris à blanc (voire argenté), qui rappelle la couleur du nickel. Il est dur et très dense. De plus, l'uranium est l'atome le plus lourd (qui contient le plus de nucléons) présent naturellement sur la Terre.
En raison de son affinité pour l'oxygène, l'uranium s'enflamme spontanément dans l'air à température élevée, voire à température ambiante lorsqu'il se trouve sous forme de microparticules.
Ainsi dans la nature, l'élément uranium se retrouve systématiquement en combinaison avec d'autres éléments, tels l'oxygène, l'azote, le soufre, le carbone ; en oxydes, nitrates, sulfates ou carbonates. On le trouve, par exemple, en combinaison avec l'oxygène dans l'uranite et la pechblende, deux des principaux minerais d'uranium, formés d'oxyde uraneux (UO2).
Enfin, les ions uranyles (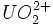 ) se dissolvent très bien dans la majorité des acides, comme dans l'acide nitrique ou fluorhydrique en donnant des sels d'uranyle tels que le nitrate d'uranyle. L'équation de la dissolution de l'ion uranyle en sel uranyle dans l'acide nitrique est la suivante :
) se dissolvent très bien dans la majorité des acides, comme dans l'acide nitrique ou fluorhydrique en donnant des sels d'uranyle tels que le nitrate d'uranyle. L'équation de la dissolution de l'ion uranyle en sel uranyle dans l'acide nitrique est la suivante :
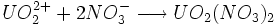
Toxicité et radiotoxicité
Sur le plan chimique, l'Uranium présente la toxicité habituelle pour un métal lourd et est du même ordre de toxicité que le plomb. La dose létale pour l'homme semble être de quelque grammes. [8] Le contenu normal d'un corps humain en équilibre avec son environnement est de l'ordre de 90 à 150 µg d'uranium, résultant d'un apport journalier de l'ordre de 1 à 2 µg/jour par l'eau courante et l'alimentation. Les deux tiers s'accumulent dans les os.
Le rein est l'organe critique pour la toxicité chimique. Le seuil de toxicité chimique rénale est estimé à 70µg/kg de poids corporel ou 16µg/g de rein (limite de 3µg/g de rein pour la protection des travailleurs). [9]
Quel que soit son enrichissement, la radioactivité de l'uranium est systématiquement du type alpha de l'ordre de 4.5MeV. De ce fait, sa radiotoxicité dépend simplement de son activité massique, et faiblement de sa composition. Elle est de l'ordre de 0.6 µSv/Bq (F) à 7 µSv/Bq (S) en inhalation, 0.05µSv/Bq (F) à 0.008µSv/Bq (S) en ingestion, les poumons et les os étant les organes critiques. [10]
La radiotoxicité de l'uranium est par conséquent du même ordre de grandeur que celle de la toxicité chimique : la radiotoxicité l'emporte pour des enrichissements supérieurs à 6%, la toxicité chimique est prépondérante sinon. [11]
L'OMS donne comme limite de potabilité une concentration maximale en uranium de 1.4 mg/l. [12] Elle recommande dans ses lignes directrices une concentration en uranium cent fois plus faible, inférieure à 15 µg/l, pour les eaux de boisson courante. [13]
Propriétés radiologiques
Produit fissible naturel
L'uranium 235 est l'unique nucléide naturel qui soit fissile, ou fissible, c'est à dire il peut par capture de neutron se scinder en deux noyaux fils avec émission de neutrons (fission nucléaire). Par suite, l'uranium enrichi en cet isotope est actuellement utilisé comme combustible nucléaire dans les réacteurs nucléaires (voir cycle du combustible nucléaire) ou encore dans les armes nucléaires, que ce soient les bombes dites "atomiques" (ou «bombes à fission»), ou comme "amorce" dans les bombes H («bombes à fusion» ou «à hydrogène»).
Au contraire de l'uranium 235, l'uranium 238, lorsqu'il capture un neutron, ne fissionne pas (sauf neutrons rapides). Il devient de l'uranium 239 instable, qui par désintégration β −, va se transformer en neptunium 239. Or ce dernier est lui-aussi radioactif β −, et va dans ce cas donner naissance à un nouveau noyau, le plutonium 239. Ce radioisotope est fissile, comme l'uranium 235. L'uranium 238 est un isotope fertile, qui peut produire des produits fissiles.
L'uranium 234 n'est lui ni fissile, ni fertile, et provient de la décomposition radioactive de l'uranium 238 comme indiqué dans la précédente section.
La fission d'un atome d'uranium 235 libère de l'ordre de 200 MeV (la valeur exacte dépendant des produits de fission). De même, la fission d'un atome de plutonium 239 libère de l'ordre de 210 MeV. Ces valeurs sont à comparer avec celles de la combustion de carburants fossiles, qui libèrent de l'ordre de 5 eV par atome de CO2 produit[14] : l'ordre de grandeur des énergies libérées par les combustibles nucléaires est un million de fois plus importante que celle des énergies fossiles chimiques.
Le potentiel d'énergie de l'uranium n'est exploité que très partiellement dans les réacteurs actuels, mais la différence reste nette : Un kilogramme d'uranium naturel permet la production de 500_000 Mégajoule (MJ) dans un réacteur conventionnel, à comparer avec les 39 MJ obtenus par un kg de gaz, 45 MJ pour un kg de pétrole, et 20 à 30 pour le charbon. [15]
Les isotopes de l'uranium naturel
L'uranium a 17 isotopes, tous radioactifs, dont 3 uniquement sont présents à l'état naturel : 238U ; 235U et 234U.
Quelles que soient les teneurs en uranium des milieux, les proportions entre les trois isotopes formant l'uranium naturel sont (quasi) précisément les mêmes : 238U : 99,28% ; 235U : 0,71% ; 234U : 0,0054%.
On trouve par conséquent dans une tonne d'uranium naturel pur 7,1 kg d'uranium 235 et 54 g d'uranium 234, le reste étant de l'uranium 238.
L'isotope 234 est systématiquement présent sur Terre, à l'état de traces, bien qu'il ait une demi-vie de uniquement 245 500 ans ; car il est constamment généré par désintégration radioactive de l'isotope 238 (après 3 étapes : une transition α donnant 234Th, puis deux transitions β- donnant 234Pa, puis 234U).
L'isotope 236 s'est "éteint" depuis longtemps, par désintégration α en 232Th, bien qu'ayant une demi-vie quasi du centuple de celle de l'isotope 234.
Activité massique
L'uranium pur est radioactif, son activité massique dépendant à la fois de son enrichissement, et de la fraîcheur de sa purification chimique. Si on considère les isotopes purs de l'uranium, l'U238 a une activité massique de 12.4 Bq/mg ; l'U235 de 80 Bq/mg; et l'U234 de 230 Bq/µg, soit 230000 Bq/mg - quatre ordre de grandeur au-dessus des précédents.
- L'uranium naturel chimiquement purifié (principalement composé d'U238 en équilibre avec son descendant l'U234) a une activité spécifique de l'ordre de 25 Bq/mg. En amont, la radioactivité d'un minerai d'uranium, où il est en équilibre avec tous les éléments radioactifs de sa chaîne de désintégration, est naturellement trois (si le Radon peut s'échapper) à sept fois plus importante.
- L'uranium enrichi est plus actif, partiellement du fait de l'activité plus importante de l'U235 (6.33 fois plus radioactif que l'U238), mais en particulier à cause de la concentration différentielle en U234 (dix mille fois plus radioactif que l'U238), systématiquement présent à l'état de traces dans la chaine de désintégration de l'U238. Elle atteint typiquement 2500 Bq/mg pour un enrichissement de 90% (uranium dit de qualité militaire). Pour les enrichissements de l'ordre de 3%, destinés aux centrales nucléaires, l'activité spécifique est de l'ordre de 60 Bq/mg.
- Inversement, l'uranium appauvri est débarrassé non seulement de sa fraction d'U235, mais également du descendant U234. Immédiatement après l'enrichissement, son activité massique tend à se rapprocher de celle de l'U238 pur, autrement dit de l'ordre de 12.5 Bq/mg (en pratique, un peu plus du fait de la présence d'U235). Cependant, l'équilibre entre U238 et ses deux premiers descendants (Thorium 234, de période 24 jours, et Protactinium 234) est atteint rapidement, en deux mois, la radioactivité spécifique à l'équilibre (avec ses deux premiers descendants) étant déjà de 41.5 Bq/mg. [16]
Utilisation
Utilisations historiques
Au départ, le minerai d'uranium était utilisé dans la céramique et la faïence pour ses pigments jaune, orange et vert.
Les isotopes 238 et 235 ont énormément d'applications, militaires surtout, mais également civiles comme, par exemple, la datation de l'âge de la Terre à partir de la datation radiométrique à l'uranium-plomb ou à l'uranium-thorium.
Contrôle des matières nucléaires
L'uranium est une matière nucléaire dont la détention est réglementée (Article R1333-1 du code de la défense).
Uranium appauvri
L'uranium appauvri, un sous-produit de l'enrichissement de l'uranium, est très prisé pour sa dureté et sa densité. De plus, il est pyrophorique et il est par conséquent employé comme arme antichar ayant un fort pouvoir pénétrant et incendiaire. À très haute vitesse, il perfore facilement les blindages en s'enflammant lors de l'impact, provoquant un incendie qui fait exploser le véhicule visé. Ainsi, des munitions à base d'uranium appauvri (obus de 20 à 30 mm des avions ou hélicoptères chasseurs de chars) ont été utilisées lors des guerres du Golfe (guerre du Koweït et guerre en Irak) et du Kosovo.
L'uranium appauvri est aussi utilisé, avec un complément de plutonium, comme nouveau combustible nucléaire (combustible MOX).
Voir aussi
Notes et références
- ↑ http ://www. cea. fr/var/plain/storage/original/application/07eade098598d926eccc4627b584b173. pdf
- ↑ [http ://www. sortirdunucleaire. org/index. php?menu=sinformer&sousmenu=revue&page=article&id=422&num=37 De l'uranium jusqu'à quand?] - Revue du Réseau Sortir du Nucléaire
- ↑ Réponses aux questions
- ↑ Avant la découverte de la radioactivité, Lord Kelvin avait estimé l'âge de la Terre à quelque vingt millions d'années, en supposant que l'unique source d'énergie capable de s'opposer au refroidissement était la chaleur résiduelle, originellement produite par la formation de la Terre. Un âge de uniquement quelques dizaines de millions d'années fut reconnu énormément trop court par les géologues, et un débat assez virulent s'ensuivit entre la communauté des géologues et celle des physiciens. Celui-ci ne devait prendre fin qu'une vingtaine d'années après la découverte de la radioactivité, trop tard pour Kelvin de faire amende honorable. Plus tard, les physiciens ont pu apporter aux géologues des méthodes de datation absolue des roches qui se basent sur la radioactivité et les abondances actuelles de certains radioéléments et de leurs produits de désintégration (cf. radiochronologie).
- ↑ Erwin Erasmus Koch (trad. André Pougetoux), Uranium, André Bonne Paris, coll. «L'homme et l'univers», Paris, 1960,225 p., p. 15
- ↑ Guide de la technique : l'énergie, Presses polytechniques et universitaires romandes, 1993.
- ↑ www. sfrp. asso. fr/MAN/pdf/12%20-%20DOREMUS-PIERRE. pdf
- ↑ Voir Health Physics - Abstract : Volume 94 (2) February 2008 p 170-179.
- ↑ D'après présentation de l'ISPN, L'uranium, propriétés et toxicité.
- ↑ Publication N° 68 de la CIPR, citée par l'IPSN dans sa présentation.
- ↑ D'après l'Uranium, propriété et toxicité.
- ↑ http ://www. lenntech. com/fran%E7ais/Norme-eau%20potable-OMS-UE. htm.
- ↑ Voir le tableau des recommandations de l'OMS [1].
- ↑ Données citées par la [http ://www. world-nuclear. org/info/inf35. html World Nuclear Association.
- ↑ D'après The Strategic Importance ofAustralia's Uranium Resources, débat parlementaire australien.
- ↑ D'après l'Uranium, propriété et toxicité.
Liens externes
- (fr) Document de l'IRSN sur L'uranium et les risques associés
- (fr) L'uranium et ses gisements en France
- (en) Ressources d'uranium et énergie nucléaire (Uranium resources and nuclear energy)
- (fr) Tableau exhaustif des données concernant l'uranium
- (fr) Caractéristiques de l'Uranium
- (en) Toxicological Profile for Uranium, ATSDR, U. S. Department of Health and Human Services
Recherche sur Google Images : |
|
"... de l'uranium et du plutonium." L'image ci-contre est extraite du site www.astrosurf.com Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (691 x 281 - 30 ko - png)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : Refaire la recherche Refaire la recherche |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/11/2008.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité